近日,3344体育会员、省部共建生物催化与酶工程国家重点实验室李爱涛教授团队在催化领域TOP期刊《ACS Catalysis》上发表了题为《A Chemoenzymatic Strategy for the Synthesis of Steroid Drugs Enabled by P450 Monooxygenase-Mediated Steroidal Core Modification》的研究论文(图1)。设计了一种化学-酶法合成群勃龙和醋酸群勃龙的方法,相比传统的全化学合成法,简化步骤且减少了副产物的产生,成本降低的同时更加绿色环保高效(图2)。团队成员研究生彭雅琴和博士生高成华为本文的并列第一作者,赵晶副教授和李爱涛教授为通讯作者。

图1. 论文首页
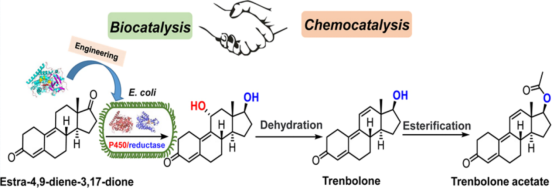
图2. 酶法合成群勃龙和醋酸群勃龙摘要图
群勃龙和醋酸群勃龙都属于甾体类药物,后者是前者的酯化衍生物。群勃龙是一种强效的蛋白同化激素,可作为选择性雄激素受体调节剂,用于治疗肥胖和雄激素不敏感综合征。相比于睾酮或诺龙,群勃龙不同之处在于碳11和12中引入了双键,抑制了其芳构化,增加了雄激素结合亲和力,并减缓其代谢,因此具有更强的合成代谢和雄激素作用。目前群勃龙的化学合成以甾体底物4,9物(1)(雌甾-4,9-二烯-3,17-二酮)为原料,通过3位二甲基醚化、17位还原、3位水解、11,12位脱氢共4步化学反应制备(图3a)。这种方法操作复杂,效率低,且需要使用有毒有机溶剂苯和丙酮,反应过程中的DDQ残留还会影响产品结晶。整个过程产生大量的废水,对环境造成污染。
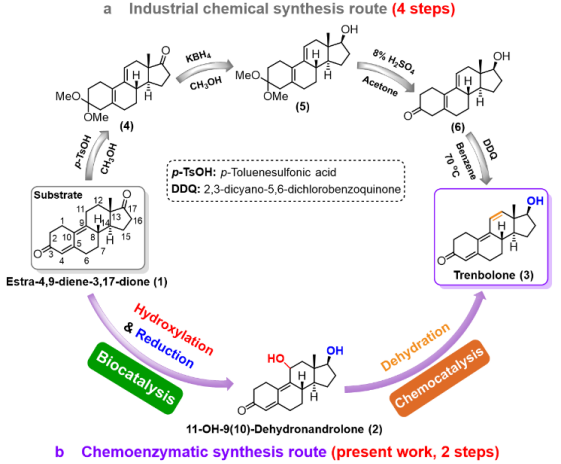
图3. a)群勃龙的工业化学合成路径;b)本研究发展的群勃龙化学酶法合成路径。
为了解决上述问题,李爱涛团队设计一种化学酶法合成群勃龙的策略(图3b),包括生物一步法催化4,9物(1)的C11-羟基化/17β-酮化还原得到11位羟化甲基双烯醇酮(2),然后化学脱水,引入C11和C12之间的双键得到群勃龙(3)。由于化学催化容易进行且产率高,所以该路径成功的关键是生物催化甾体的羟化/还原步骤。为了实现这一目标,甾体的还原可以选取已报道的高活性甾体17β羟基脱氢酶进行,所以主要问题是开发一种有效的酶促方法来选择性地进行甾体的C11-羟基化。考虑到目前P450酶在甾体羟化上具有巨大的应用潜力,作者以4,9物(1)为底物,对实验室已有的P450-BM3单加氧酶突变体库进行筛选,发现了一个P450-BM3突变体LG-23 (R47W/S72W/F77Y/V78L/F81I/A82L/F87G/T88S/M177T/M185Q/L188Q/I209T/A328G/A330W)对4,9物(1)具有约90%选择性,产物经鉴定为C11α羟基化产物,且同时对甲基双烯醇酮(8)具有78%的C11α羟基化选择性。且通过对LG-23进行改造,得到了同时对4,9物(1)和甲基双烯醇酮(8)11α羟基化选择性进一步提高的突变体LG-23/T438S(选择性分别为94%和92%)。通过构建并表达P450-BM3突变体LG-23/T438S和17β羟基脱氢酶17β-HSDcl的全细胞生物催化剂,一步法实现了4,9物(1)到11位羟化甲基双烯醇酮(2)的转化(图4)。最后,通过化学酶法实现了大规模合成了群勃龙及其酯化产物醋酸群勃龙的高产工艺(图5)。有趣的是,P450-BM3 LG-23在该课题组之前的工作中对睾酮或诺龙等甾体的主要羟化选择性为7β。因此,通过对P450-BM3突变体LG23和LG23/T438S进行分子动力学模拟,阐明了其不同区域/立体选择性的分子催化机制(图6)。
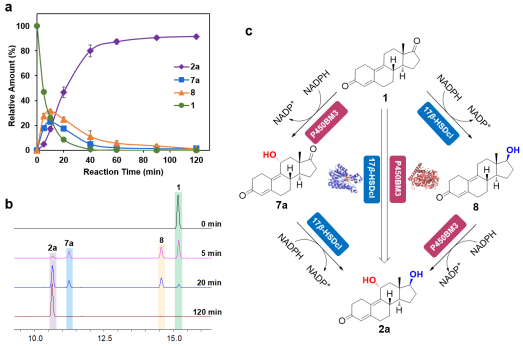
图4. 大肠杆菌(LG-23/T438S+HSDcl)一步法催化 4,9物(1)转化为11α羟化甲基双烯醇酮(2)。
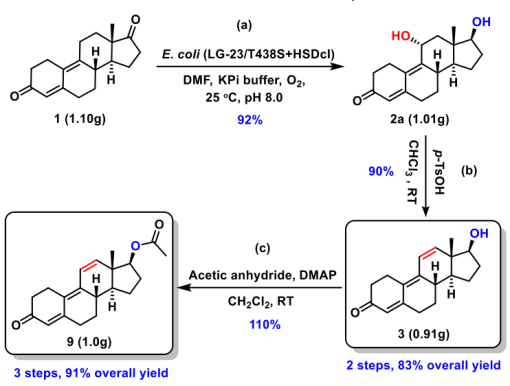
图5. 化学酶法大规模合成群勃龙(3)和醋酸群勃龙(9)。
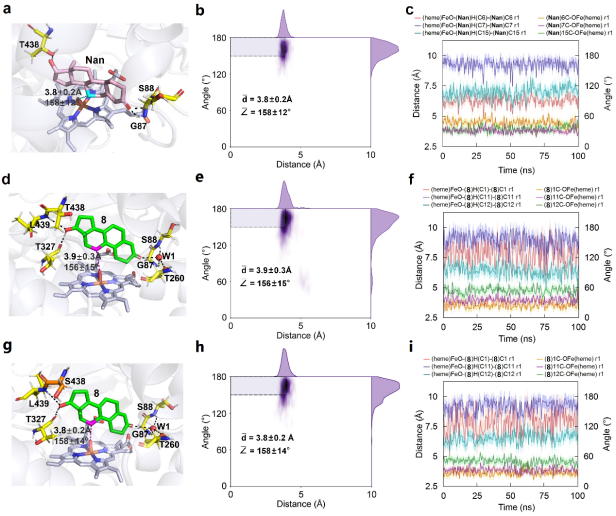
图6. P450-BM3突变体与诺龙或甲基双烯醇酮(8)分子动力学模拟。
据悉,上述研究得到了科技部国家重点研发计划(2019YFA0905000)、国家自然科学基金面上项目(21977026),湖北省杰出青年学者(20120CFA072)和创新基地湖北省学科引进人才(2019BJH021),以及省部共建生物催化与酶工程国家重点实验室自主研发基金等项目的资助。
论文链接:https://pubs.acs.org/doi/10.1021/acscatal.1c05776




